Оплата и способы получения
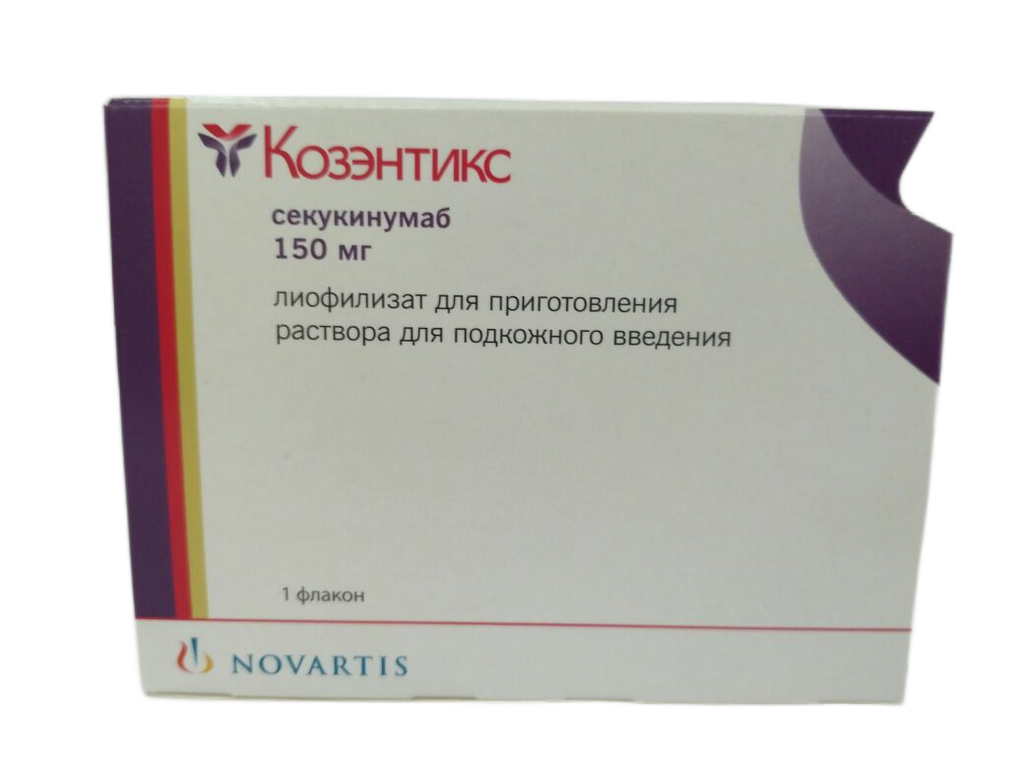
Инструкция на Козэнтикс 150 мг, лиофилизат для приготовления раствора для подкожного введения, 1 шт.
Состав
Лиофилизат для приготовления раствора для подкожного введения. - 1 фл.:
- Действующее вещество: секукинумаб - 150,00 мг;
- Вспомогательные вещества: сахароза - 92,43 мг; гистидин/гистидина гидрохлорида моногидрат - 4,656 мг; полисорбат-80 - 0,60 мг.
Лиофилизат для приготовления раствора для подкожного введения, по 150 мг во флакон из бесцветного стекла класса I вместимостью 6 мл, укупоренном серой резиновой пробкой, обкатанной алюминиевым колпачком с отщелкивающейся крышкой из полипропилена.
По 1 флакону вместе с инструкцией по медицинскому применению в пачку.
Описание
Белого цвета порошок или аморфная масса.
Фармакологическое действие
Механизм действия
Секукинумаб представляет собой полностью человеческое антитело (иммуноглобулин G1 (IgG1), которое селективно связывается и нейтрализует провоспалительный цитокин - интерлейкин-17А (ИЛ-17А). Секукинумаб оказывает направленное действие на ИЛ-17 и ингибирование его взаимодействия с рецептором ИЛ-17, который экспрессируется разными типами клеток, включая кератиноциты и синовиоциты. В результате этого секукинумаб ингибирует высвобождение провоспалительных цитокинов, хемокинов и медиаторов повреждения тканей, и снижает вклад ИЛ-17А в аутоиммунные и воспалительные заболевания. В клинически значимых концентрациях секукинумаб достигает кожи и снижает концентрацию местных воспалительных маркеров. Прямым следствием лечения секукинумабом является снижение выраженности покраснения, уплотнения и шелушения, являющихся результатом псориатического поражения.
ИЛ-17A является естественным цитокином, который участвует в нормально протекающих реакциях воспаления и иммунного ответа. ИЛ-17А играет ключевую роль в патогенезе развития бляшечного псориаза, псориатического артрита и анкилозирующего спондилита. Повышение концентрации ИЛ-17А, продуцируемого лимфоцитами и врожденными иммунными клетками, было обнаружено в крови и пораженных участках кожи у пациентов с бляшечным псориазом, псориатическим артритом и анкилозирующим спондилитом. Продукция ИЛ-17А является высокой в пораженной коже по сравнению с неповрежденной кожей у пациентов с бляшечным псориазом. В синовиальной жидкости у пациентов с псориатическим артритом и в субхондральном костном мозге костей фасеточных суставов у пациентов с анкилозирующим спондилитом обнаруживается высокая концентрация клеток, продуцирующих ИЛ-17А.
ИЛ-17А также способствует развитию воспаления тканей, инфильтрации нейтрофилами, деструкции костей и тканей, а также ремоделированию тканей, включая ангиогенез и фиброз.
Фармакодинамика
Концентрация общего ИЛ-17А (свободного и связанного с секукинумабом ИЛ-17А) повышается вследствие снижения клиренса, связанного с секукинумабом ИЛ-17А в течение 2-7 дней у пациентов, получающих секукинумаб, указывая на то, что секукинумаб селективно захватывает свободный ИЛ-17А, играющий ключевую роль в патогенезе бляшечного псориаза.
В исследовании с секукинумабом инфильтрация эпидермальными нейтрофилами и различными нейтрофилсвязанными маркерами, которые повышены в поврежденной коже у пациентов с бляшечным псориазом, были значительно снижены после одной-двух недель лечения.
На фоне терапии секукинумабом у пациентов с псориатическим артритом и анкилозирующим спондилитом в течение 1-2 недель отмечалось снижение концентрации С-реактивного белка, являющегося маркером воспаления.
Фармакокинетика
Всасывание
После однократного подкожного введения дозы 150 мг или 300 мг при бляшечном псориазе, максимальная концентрация секукинумаба в сыворотке крови составляла, соответственно, 13,7±4,8 мкг/мл или 27,3±9,5 мкг/мл в интервале между 5 и 6 днем после введения.
После первоначального еженедельного введения во время первого месяца, время достижения максимальной концентрации было между 31 и 34 днем.
Максимальная концентрация в равновесном состоянии (Cmax, s s ) после подкожного введения 150 мг или 300 мг составила 27,6 мкг/мл и 55,2 мкг/мл, соответственно. Равновесное состояние достигается после 20 недель при ежемесячном режиме введения.
По сравнению с экспозицией после однократной дозы, отмечено двукратное повышение максимальной концентрации и площади под кривой зависимости концентрации от времени (AUC) после многократного ежемесячного введения во время поддерживающей терапии. Секукинумаб абсорбируется со средним показателем абсолютной биодоступности 73%.
Распределение
Средний объем распределения в терминальной фазе (Vz) после однократного внутривенного введения варьировал между 7,10 и 8,60 л у пациентов с бляшечным псориазом, вероятно, что секукинумаб ограниченно распределяется на периферии.
Концентрации секукинумаба в межклеточной жидкости кожи у пациентов с бляшечным псориазом варьировали от 28% до 39% от таковой в сыворотке крови на 1-2 неделе после однократного подкожного введения секукинумаба в дозе 300 мг.
Выведение
Средний системный клиренс (CL) у пациентов с бляшечным псориазом составил 0,19 л/сутки. Клиренс был дозо- и времязависимым, как и предполагалось для терапевтического IgGl моноклонального антитела, взаимодействующего с растворимой цитокиновой мишенью, такой как ИЛ-17А.
Средний период полувыведения у пациентов с бляшечным псориазом составлял 27 дней. Период полувыведения у отдельных пациентов с псориазом варьировал от 17 до 41 дня.
Линейность / нелинейность
Фармакокинетические параметры при однократном и многократном введении секукинумаба у пациентов с бляшечным псориазом были определены в отдельных исследованиях с внутривенным введением доз, варьировавших от 1 x 0,3 мг/кг до 3х10 мг/кг и с подкожным введением доз, варьировавших от 1х25 мг до многократной дозы 300 мг. При всех режимах дозирования экспозиция была пропорциональна дозе.
Фармакокинетические параметры секукинумаба у пациентов с псориатическим артритом, анкилозирующим артритом и бляшечным псориазом одинаковы.
Фармакокинетика в особых клинических случаях
Пациенты старше 65 лет
Основываясь на популяционном анализе фармакокинетических параметров, клиренс у пациентов старше 65 лет и пациентов младше данной возрастной группы был сходным.
Пациенты с нарушениями функции печени или почек
Доступные данные по фармакокинетике у пациентов с нарушениями функции печени или почек отсутствуют.
Козэнтикс: Показания
- Лечение псориаза среднетяжелой и тяжелой степени у взрослых пациентов, которым показана системная терапия или фототерапия.
- Лечение активного псориатического артрита в режиме монотерапии или в комбинации с метотрексатом у взрослых пациентов при недостаточном ответе на предшествующую терапию базисными препаратами.
- Лечение активного анкилозирующего спондилита у взрослых пациентов, при недостаточном ответе на стандартную терапию.
Инструкция
Инструкции по приготовлению раствора препарата Козэнтикс
- Доведите флакон с препаратом Козэнтикс, лиофилизат для приготовления раствора для инъекций, 150 мг, и стерильную воду для инъекций до комнатной температуры.
- Наберите чуть более 1,0 мл стерильной воды для инъекций в одноразовый шприц с градуировкой 1 мл и выровняйте на отметке 1,0 мл.
- Снимите пластиковый колпачок с флакона.
- Вставьте иглу шприца во флакон, содержащий лиофилизат препарата Козэнтикс, через центр резиновой пробки и восстановите лиофилизат медленным введением 1,0 мл стерильной воды для инъекций во флакон. Струя стерильной воды для инъекций должна быть направлена на лиофилизат.
Наклоните флакон под углом около 45° и, удерживая кончиками пальцев, аккуратно вращайте приблизительно в течение 1 минуты. Не встряхивайте и не переворачивайте флакон.
Оставьте флакон стоять при комнатной температуре не менее, чем на 10 минут для достижения полного растворения. Может наблюдаться вспенивание раствора.
Наклоните флакон под углом около 45° и, удерживая кончиками пальцев, аккуратно вращайте приблизительно в течение 1 минуты. Не встряхивайте и не переворачивайте флакон.
Оставьте флакон в вертикальном положении при комнатной температуре приблизительно на 5 минут. Полученный раствор должен быть прозрачным или опалесцирующим. Его цвет может варьировать от бесцветного до светло-желтого.
Не используйте препарат, если лиофилизат полностью не растворяется, или если жидкость содержит легко заметные частицы, а также, если она мутная или коричневого цвета. Подготовьте необходимое количество флаконов (1 флакон для дозы 150 мг, 2 флакона для дозы 300 мг).
После приготовления раствор для подкожных инъекций может быть введен незамедлительно или может храниться при температуре от 2°С до 8°С не более 24 ч. Не замораживать. После хранения при температуре от 2°С до 8°С раствор перед введением следует выдержать при комнатной температуре около 20 минут. Раствор должен быть использован в течение 1 ч после изъятия из условий хранения при температуре от 2°С до 8°С.
Инструкция по введению раствора препарата Козэнтикс
Наклоните флакон под углом приблизительно 45° и поместите кончик иглы на дно флакона с раствором при наборе в шприц. Не переворачивайте флакон.
Осторожно отберите чуть более 1,0 мл раствора для подкожного введения из флакона в одноразовый шприц с градуировкой 1 мл и с иглой подходящего размера (например, «21G х 2»). Данная игла будет использована только для забора препарата Козэнтикс в одноразовый шприц. Подготовьте необходимое количество шприцев (1 шприц для дозы 150 мг, 2 шприца для дозы 300 мг).
Удерживая шприц иглой вверх, слегка постучите по шприцу для перемещения пузырьков воздуха кверху.
Замените иглу, использованную для забора препарата, на другую, размером «27 G х /г».
Замените иглу, использованную для забора препарата, на другую, размером «27 G х /г».
Замените иглу, использованную для забора препарата, на другую, размером «27G х ».
Удалите пузырьки воздуха и продвиньте поршень до отметки 1,0 мл.
Продезинфицируйте место инъекции спиртовым тампоном.
Введите раствор препарата Козэнтикс подкожно в переднебоковую поверхность бедра или нижнюю часть живота (за исключением пятисантиметровой области вокруг пупка) или наружную поверхность плеча. Места инъекции следует каждый раз менять. Не следует вводить в область поврежденной кожи (истончение, покраснение, раздражение, уплотнение, шелушение). Избегайте введения в места с наличием шрамов и растяжек.
Оставшийся раствор во флаконе не должен использоваться и должен быть утилизирован. Флаконы предназначены только для одноразового использования. Утилизируйте использованный шприц в контейнер для острых предметов (закрывающийся, устойчивый к проколам контейнер). В целях Вашей безопасности и здоровья других, иглы и использованные шприцы ни в коем случае не должны использоваться повторно.
Способ применения и дозы
Препарат Козэнтикс вводится путем подкожной инъекции. По возможности следует избегать в качестве места для инъекции участки кожи, пораженные псориазом.
Лечение псориаза среднетяжелой и тяжелой степени у взрослых пациентов, которым показана системная терапия или фототерапия: рекомендуемая доза составляет 300 мг в качестве начальной дозы на 0, 1, 2 и 3 неделе путем подкожной инъекции, которая в последующем вводится ежемесячно в качестве поддерживающей дозы, начиная с 4-й недели. Каждая доза 300 мг вводится в виде двух отдельных подкожных инъекций по 150 мг.
Лечение активного псориатического артрита в режиме монотерапии или в комбинации с метотрексатом у взрослых пациентов при недостаточном ответе на предшествующую терапию базисными препаратами: рекомендуемая доза составляет 150 мг в качестве начальной дозы на 0, 1, 2 и 3 неделе путем подкожной инъекции, которая в последующем вводится ежемесячно в качестве поддерживающей дозы, начиная с 4-й недели. Для пациентов с неадекватным ответом на терапию анти-ФНОα (фактор некроза опухоли α) препаратами или для пациентов с псориазом средней и тяжелой степени тяжести рекомендуемая доза составляет 300 мг в качестве начальной дозы на 0, 1, 2 и 3 неделе путем подкожной инъекции, которая в последующем вводится ежемесячно в качестве поддерживающей дозы, начиная с 4-й недели. Каждая доза 300 мг вводится в виде двух отдельных подкожных инъекций по 150 мг.
Лечение активного анкилозирующего спондилита у взрослых пациентов, при недостаточном ответе на стандартную терапию: рекомендуемая доза составляет 150 мг в качестве начальной дозы на 0, 1, 2 и 3 неделе путем подкожной инъекции, которая в последующем вводится ежемесячно в качестве поддерживающей дозы, начиная с 4-й недели.
Особые группы пациентов
Пациенты с нарушением функции печени или почек
Отсутствуют данные по применению препарата Козэнтикс у данной группы пациентов.
Пациенты моложе 18 лет
Эффективность и безопасность препарата у детей до 18 лет не установлена.
Пациенты старше 65 лет
Коррекция дозы не требуется.
Применение при беременности и кормлении грудью
Исследования у лабораторных животных не показали прямого или косвенного негативного влияния на беременность, эмбриональное/фетальное развитие, роды или постнатальное развитие. Так как отсутствуют адекватные данные применения препарата Козэнтикс у беременных женщин, его применение у данной категории пациентов не рекомендовано. Неизвестно, проникает ли секукинумаб в грудное молоко у человека. Поскольку иммуноглобулины экскретируются с грудным молоком человека, не рекомендуется применять препарат Козэнтикс в период грудного вскармливания. Данных о влиянии препарата Козэнтикс на фертильность мужчин и женщин нет. В исследованиях препарата Козэнтикс у животных снижения фертильности отмечено не было.
Козэнтикс: Противопоказания
Тяжелые реакции гиперчувствительности к секукинумабу или к другим вспомогательным компонентам препарата.
Клинически значимые инфекции в стадии обострения (например, активный туберкулез). Возраст до 18 лет в связи с отсутствием данных по эффективности и безопасности. Беременность и период грудного вскармливания.
C осторожностью
Следует соблюдать осторожность при назначении препарата Козэнтикс пациентам с хроническими инфекциями или с анамнестическими указаниями на них из-за повышенного риска развития инфекции, а также пациентам с активной стадией болезни Крона.
Так как съемный колпачок предварительно заполненного шприца с устройством для пассивной защиты иглы/предварительно заполненного шприца в автоинжекторе содержит производные натурального каучукового латекса, необходимо соблюдать осторожность при применении препарата Козэнтикс у пациентов с индивидуальной непереносимостью латекса. Пациенты, получающие препарат Козэнтикс, могут быть вакцинированы инактивированными или убитыми вакцинами, введение живых вакцин не должно проводиться.
Если у Вас одно из перечисленных заболеваний, перед приемом препарата обязательно проконсультируйтесь с врачом.
Козэнтикс: Побочные действия
Наиболее часто встречаемыми нежелательными явлениями (НЯ) на фоне применения препарата Козэнтикс были инфекции верхних дыхательных путей (наиболее часто назофарингит, ринит). Большинство из них были слабо или умеренно выражены.
НЯ перечислены в соответствии с системно-органным классом медицинского словаря для нормативно-правовой деятельности MedDRA. В пределах каждого системно-органного класса НЯ распределены по частоте возникновения в порядке уменьшения их важности. Для оценки частоты использованы следующие критерии: очень часто (≥1/10); часто (от ≥1/100 до
Инфекционные и паразитарные заболевания : очень часто - назофарингит, инфекция верхних отделов дыхательных путей; часто - ринит, фарингит, герпетическая инфекция слизистой оболочки полости рта; нечасто - синусит, тонзиллит, кандидозная инфекция полости рта, грибковое поражение кожи, воспаление наружного уха.
Нарушения со стороны крови и лимфатической системы: нечасто - нейтропения.
Нарушения со стороны органов зрения: нечасто - конъюнктивит.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: часто - ринорея.
Нарушения со стороны желудочно-кишечного тракта: часто - диарея.
Нарушения со стороны кожи и подкожных тканей: часто — крапивница; редко - анафилактические реакции.
Иммуногенность
По данным клинических исследований препарата Козэнтикс в
Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Передозировка
В ходе клинических исследований препарата Козэнтикс сообщений о случаях передозировки не было.
В ходе клинических исследований дозы до 30 мг/кг (т.е. приблизительно 2000-3000 мг) вводились внутривенно без развития дозолимитирующей токсичности. В случае передозировки рекомендуется наблюдение за пациентами для выявления признаков и симптомов НЯ. При необходимости следует незамедлительно провести симптоматическое лечение.
Взаимодействие
Препарат Козэнтикс нельзя назначать вместе с живыми вакцинами. Данных о взаимодействии препарата Козэнтикс с другими лекарственными средствами у человека нет. Нет прямых данных, свидетельствующих об участии ИЛ-17А в экспрессии изоферментов системы цитохрома CYP450. Повышенная концентрация цитокинов в условиях хронического воспалительного процесса подавляет образование некоторых изоферментов системы цитохрома. Таким образом, противовоспалительная терапия, в т. ч. секукинумабом, ингибитором ИЛ-17А, может привести к нормализации активности изоферментов цитохрома CYP450, сопровождающейся уменьшением экспозиции одновременно применяемых препаратов, метаболизм которых осуществляется с участием указанных изоферментов. Т. о. не может быть исключено клинически значимое влияние на препараты, являющиеся субстратами изоферментов системы цитохрома с узким терапевтическим индексом, доза которых подбирается индивидуально (например, варфарин). Следует рассмотреть возможность проведения терапевтического контроля при начале терапии секукинумабом у пациентов, получающих лечение препаратами вышеуказанных групп.
При назначении препарата Козэнтикс одновременно с метотрексатом и/или глюкокортикостероидами у пациентов с псориатическим артритом и анкилозирующим спондилитом лекарственных взаимодействий выявлено не было.
Препарат Козэнтикс не должен смешиваться с какими-либо лекарственными препаратами.
Меры предосторожности
Инфекции
Препарат Козэнтикс может повышать риск развития инфекций. В клинических исследованиях у пациентов, получавших препарат Козэнтикс, наблюдались случаи развития инфекции, большинство которых были легкой или средней степени тяжести. Следует соблюдать осторожность при решении вопроса о применении препарата Козэнтикс у пациентов с хроническими инфекциями или с наличием в анамнезе рецидивирующей инфекции.
Пациенты должны быть проинформированы о необходимости обращения к врачу в случае появления признаков и симптомов, предполагающих развитие инфекции. В случае развития тяжелой инфекции пациент должен находиться под наблюдением, препарат Козэнтикс не должен вводиться до разрешения инфекции.
В клинических исследованиях не сообщалось о повышенной восприимчивости к туберкулезу, тем не менее, препарат Козэнтикс не следует назначать пациентам с активной формой туберкулеза. До начала лечения препаратом Козэнтикс должно быть принято решение о проведении противотуберкулезной терапии у пациентов с латентными формами туберкулеза.
Болезнь Крона
Следует соблюдать осторожность при назначении препарата Козэнтикс пациентам с обострением болезни Крона, поскольку в клинических исследованиях наблюдалось усугубление течения болезни Крона, в некоторых случаях тяжелое. Пациенты с обострением болезни Крона на фоне лечения препаратом Козэнтикс должны тщательно наблюдаться.
Реакции гиперчувствительности
При возникновении анафилактических или других серьезных аллергических реакций, применение препарата Козэнтикс следует немедленно прекратить, необходимо немедленно начать соответствующую симптоматическую терапию.
Пациенты с гиперчувствительностью к латексу
Съемный колпачок предварительно заполненного шприца с устройством для пассивной защиты иглы/предварительно заполненного шприца в автоинжекторе содержит производные натурального каучукового латекса. Хотя натуральный каучуковый латекс не обнаруживается в колпачке, безопасность применения препарата Козэнтикс в предварительно заполненном шприце с устройством для пассивной защиты иглы/предварительно заполненном шприце в автоинжекторе у пациентов с гиперчувствительностью к латексу не изучалась.
Вакцинация
Вакцинация живыми вакцинами не должна проводиться на фоне лечения препаратом Козэнтикс.
Пациенты, получающие препарат Козэнтикс, могут быть вакцинированы инактивированными или убитыми вакцинами. После вакцинации инактивированной менингококковой и гриппозной вакциной, у пациентов, получавших препарат Козэнтикс, отмечался адекватный иммунный ответ в виде как минимум четырехкратного повышения титра антител к менингококковой и гриппозной вакцине. Эти данные свидетельствуют о том, что препарат Козэнтикс не подавляет развитие иммунного ответа на введение менингококковой и гриппозной вакцины.
Влияние на фертильность
Женщинам с сохраненным детородным потенциалом следует использовать надежные методы контрацепции во время лечения препаратом и как минимум в течение 20 недель после прекращения терапии.
Влияние на способность управлять транспортными средствами и/или механизмами
Отсутствуют данные о влиянии препарата на способность управлять транспортными средствами и/или механизмами.
Условия отпуска
Характеристики
Цены в аптеках на Козэнтикс 150 мг, лиофилизат для приготовления раствора для подкожного введения, 1 шт.

История стоимости Козэнтикс 150 мг, лиофилизат для приготовления раствора для подкожного введения, 1 шт.
Цены Козэнтикс и наличие в аптеках в Москве
Отзывы о Козэнтикс
Дистанционная торговля лекарственными препаратами осуществляется исключительно аптечными организациями, имеющими действующую лицензию на фармацевтическую деятельность, а также разрешение на дистанционную торговлю лекарственными препаратами. Дистанционная торговля рецептурными лекарственными препаратами, наркотическими и психотропными, а также спиртосодержащими лекарственными препаратами запрещена действующим законодательством РФ и не осуществляется.
На информационном ресурсе применяются рекомендательные технологии .