Оплата и способы получения
Аналоги Тарцева

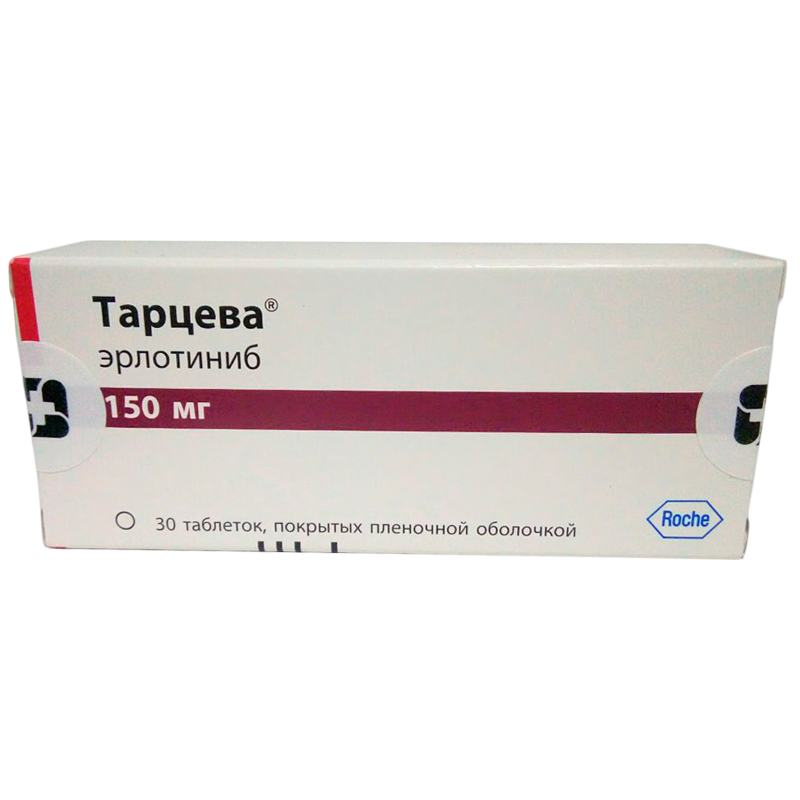
Инструкция на Тарцева 150 мг, таблетки, покрытые пленочной оболочкой, 30 шт.
Состав
1 таблетка содержит:
Действующие вещества: эрлотиниба гидрохлорид 163,93 мг, что соответствует содержанию эрлотиниба 150 мг.
Вспомогательные вещества: лактозы моногидрат - 103,82 мг, целлюлоза микрокристаллическая - 132,75 мг, карбоксиметилкрахмал натрия - 36 мг, натрия лаурилсульфат - 4,5 мг, магния стеарат - 9 мг.
Состав оболочки: 13,5-22,5 мг (гипромеллоза, гипролоза, макрогол 400, титана диоксид (Е171)); допускается использование готовой смеси Opadry White Y-5-7068.
Состав коричневых чернил: шеллак, модифицированный в этаноле денатурированном (спирте метилированном) 74 ОР, краситель железа оксид красный (Е172), бутанол, изопропанол, пропиленгликоль, вода очищенная, этанол денатурированный (спирт метилированный) 74 ОР, аммиака раствор концентрированный; допускается использование готовых чернил Opacode Brown S-1-26604.
В блистере 10 таблеток. В картонной упаковке 3 блистера.
Описание
Фармакологическое действие
Фармакодинамика
Эрлотиниб мощно ингибирует внутриклеточное фосфорилирование рецептора эпидермального фактора роста HER1 /EGFR(HER1 = рецептор эпидермального фактора роста человека 1 типа/ EGFR = рецептор эпидермального фактора роста). Экспрессия HER1 /EGFR наблюдается на поверхности как нормальных, так и раковых клеток. На доклинических моделях ингибирование фосфотирозина EGFR тормозит рост линий опухолевых клеток и/или приводит к их гибели.
Мутации EGFR могут привести к постоянной активации пролиферативных и антиапоптотических сигнальных путей в клетке. Высокая эффективность эрлотиниба в отношении блокирования EGFR-зависимых сигнальных путей в опухолях, несущих мутацию EGFR, обусловлена прочным связыванием эрлотиниба с АТФ-связывающим участком мутированного киназного домена EGFR. При этом блокируется каскад сигнальных реакций, в результате чего угнетается пролиферация клеток и запускается внутренний путь клеточной гибели.
Фармакокинетика
Экспозиция
После приема внутрь 150 мг эрлотиниба в равновесном состоянии медиана C max эрлотиниба в плазме 1,995 нг/мл. Перед приемом следующей дозы через 24 ч медиана C min эрлотиниба в плазме 1,238 нг/мл. Медиана AUC в междозовом интервале при достижении равновесной концентрации составляет 41,3 мкг/ч × мл.
Всасывание
Эрлотиниб хорошо всасывается после приема внутрь. Имеет продолжительную фазу всасывания, а среднее значение TС max в плазме составляет 4 ч. Согласно данным исследования на здоровых добровольцах биодоступность эрлотиниба - 59%, прием пищи может увеличивать его биодоступность.
После всасывания в крови эрлотиниб на 95% находится в связанном состоянии, в первую очередь с белками плазмы крови (альбумин и альфа1- кислый гликопротеин). Свободная фракция составляет приблизительно 5%.
Распределение
Кажущийся V d - 232 л с распределением в ткань опухоли. В образцах опухолевой ткани человека на 9 день лечения эрлотинибом в дозе 150 мг/сутки средняя концентрация эрлотиниба равна 1,185 нг/г, что составляет 63% от С mах в плазме в равновесном состоянии. Концентрация основных активных метаболитов в ткани опухоли 160 нг/г, что соответствует 113% C max в плазме в равновесном состоянии. Исследования по изучению распределения в тканях меченного 14 С эрлотиниба после перорального приема у бестимусных мышей с мутацией по гену nude с НТ5 опухолевым ксенотрансплантатом (с использованием общей ауторадиографии) продемонстрировали быстрое и интенсивное распределение в тканях. C max в ткани составила около 73% концентрации эрлотиниба, TС max в ткани - 1 ч.
Метаболизм
Эрлотиниб метаболизируется изоферментами системы цитохрома Р450 главным образом при участии изофермента CYP3A4 и в меньшей степени CYP1A2.
Внепеченочный метаболизм посредством изофермента CYP3A4 в кишечнике, изофермента CYP1А1 в легких, изофермента CYP1B1 в ткани опухоли обеспечивает метаболический клиренс эрлотиниба. Исследования in vitro свидетельствуют о том, что 80-95% эрлотиниба метаболизируется при участии изофермента CYP3A4.
Метаболизм происходит тремя путями: 1) О-деметилирование одной из боковых или обеих цепей с последующим окислением до карбоновых кислот; 2) окисление ацетиленовой части молекулы с последующим гидролизом до арилкарбоновой кислоты; 3) ароматическое гидроксилирование фенила-цетиленовой части молекулы. Основные метаболиты образуются в результате О-деметилирования одной из боковых цепей и обладают активностью, сравнимой с эрлотинибом в доклинических исследованиях in vitro и на моделях опухолей in vivo. Они присутствуют в плазме в концентрациях, которые составляют < 10% концентрации эрлотиниба, их фармакокинетика аналогична фармакокинетике эрлотиниба.
Выведение
Метаболиты и следовые количества эрлотиниба выводятся, преимущественно, с желчью ( > 90%), почками выводится небольшое количество перорально введенной дозы.
Клиренс
При монотерапии препаратом Тарцева® средний клиренс 4,47 л/ч, а средний T 1/2 36,2 ч. Следовательно, ожидается, что C ss будет достигнута на 7-8 день. Значительной связи между клиренсом, возрастом, массой тела, полом и расой больного не выявлено.
Фармакокинетика эрлотиниба зависела от следующих показателей: концентрации общего билирубина, альфа1-кислого гликопротеина и курения в настоящее время. Снижение клиренса эрлотиниба отмечено при повышении концентрации общего билирубина и альфа1-кислого гликопротеина, а его повышение - у курильщиков.
Одновременное применение гемцитабина не влияло на клиренс эрлотиниба.
Фармакокинетика у особых групп пациентов
Специальные исследования у детей и пожилых пациентов не проводились.
Нарушение функции печени
Эрлотиниб в основном выводится с желчью. Экспозиция эрлотиниба одинакова у пациентов со средней степенью нарушения печеночной функции (7-9 баллов по шкале Чайлд-Пью) и у пациентов без нарушения функции печени, в т.ч. и у пациентов с первичным очагом опухоли в печени или с метастазами в печень.
Нарушение функции почек
Эрлотиниб и его метаболиты выводятся почками в незначительных количествах - менее 9% однократной дозы. Клинические исследования у больных с нарушением функции почек не проводились.
Курение
Курение увеличивает клиренс и снижает экспозицию эрлотиниба. AUC 0-infinity у курящих людей составила 1/3 от AUC 0-infinity у некурящих/бывших курильщиков. Наблюдавшееся снижение экспозиции у активных курильщиков возможно связано с индукцией изофермента CYP1A1 в легких и изофермента CYP1А2 в печени.
У курящих пациентов с немелкоклеточным раком легкого C ss min составила 0,65 мкг/мл, что в 2 раза ниже, чем у некурящих/бывших курильщиков (1,28 мкг/мл). При этом кажущийся клиренс эрлотиниба увеличивается на 24%.
При увеличении дозы эрлотиниба от 150 мг до 300 мг (максимально переносимая доза) наблюдается дозозависимое увеличение экспозиции эрлотиниба. C ss min эрлотиниба в дозе 300 мг у курильщиков составляла 1,22 мкг/мл.
Тарцева: Показания
Способ применения и дозы
Препарат принимают внутрь, 1 раз/сутки, не менее чем за 1 ч до или через 2 ч после приема пищи.
Немелкоклеточный рак легкого
Назначают по 150 мг ежедневно. При появлении признаков прогрессирования заболевания или развития непереносимой токсичности терапию препаратом Тарцева®следует прекратить.
Рак поджелудочной железы
Назначают по 100 мг ежедневно, длительно, в комбинации с гемцитабином (см. также инструкцию по медицинскому применению гемцитабина, показание - рак поджелудочной железы). При появлении признаков прогрессирования заболевания терапию препаратом Тарцева® следует прекратить. Если у пациента в течение 4-8 недель лечения не развивается сыпь, дальнейшую терапию препаратом Тарцева® следует пересмотреть.
Особые указания по дозированию
При сопутствующей терапии субстратами или модуляторами изофермента CYP3А4 может потребоваться изменение дозы препарата Тарцева®. При необходимости доза препарата Тарцева® снижается на 50 мг постепенно.
Нарушение функции печени
Несмотря на то, что экспозиция эрлотиниба была одинаковой у пациентов со средней степенью нарушения печеночной функции (7-9 баллов по шкале Чайлд-Пью) и у пациентов без нарушения функции печени, необходимо проявлять осторожность при назначении препарата Тарцева® больным с нарушением функции печени. Прием препарата Тарцева® не рекомендуется при тяжелом нарушении функции печени.
При развитии тяжелых нежелательных реакций, следует рассмотреть вопрос о снижении дозы или перерыве терапии препаратом Тарцева®. Безопасность и эффективность у пациентов с тяжелым нарушением функции печени (активность АЛТ и АСТ более чем в 5 раз выше ВГН) не изучались.
Нарушение функции почек
Безопасность и эффективность у больных с нарушением функции почек (концентрация креатинина в сыворотке крови более чем в 1,5 раза выше ВГН) не изучались. Согласно фармакокинетическим данным при легкой и умеренной почечной недостаточности коррекции дозы не требуется. Прием препарата Тарцева® не рекомендуется при тяжелом нарушении функции почек.
Детский возраст
Безопасность и эффективность препарата Тарцева® у больных в возрасте до 18 лет не изучались.
Курение
Курение снижает экспозицию эрлотиниба на 50-60%. Максимально переносимая доза препарата Тарцева® у курящих пациентов с немелкоклеточным раком легкого составляет 300 мг. Отдаленные результаты эффективности и безопасности применения доз выше рекомендованных в начале лечения у пациентов, продолжающих курение, не установлены.
Тарцева: Противопоказания
- Тяжелое нарушение функции печени (10 и более баллов по шкале Чайлд-Пью);
- тяжелое нарушение функции почек;
- беременность;
- период кормления грудью;
- возраст до 18 лет (безопасность и эффективность не изучались);
- выраженная гиперчувствительность к эрлотинибу или к любому компоненту препарата.
С осторожностью: следует назначать препарат курящим пациентам; при нарушениях функции печени; пациентам с редкими наследственными заболеваниями, такими как непереносимость галактозы, дефицит лактазы или глюкозо-галактозная мальабсорбция; одновременно с приемом мощных индукторов или ингибиторов изофермента CYP3A4; при пептической язве или дивертикулярной болезни в настоящее время или в анамнезе; одновременно с антиангиогенными лекарственными средствами, ГКС, НПВП; пациентам, которые получают химиотерапию, которая включает таксаны.
Тарцева: Побочные действия
Передозировка
Взаимодействие
Особые указания
Перед началом лечения у пациентов с немелкоклеточным раком легкого, ранее не получавших химиотерапию, необходимо провести анализ на наличие мутации L858R в 21 экзоне или делеции в 19 экзоне гена EGFR.
Интерстициальное заболевание легких (ИЗЛ)
У больных с немелкоклеточным раком легкого, раком поджелудочной железы или другими распространенными солидными опухолями, получавших препарат Тарцева®, ИЗЛ-подобные симптомы, в т.ч. с летальным исходом, диагностировались нечасто. Общая частота случаев ИЗЛ-подобных явлений у пациентов, получавших препарат Тарцева®, составляет 0.6%. Наиболее частыми диагнозами у больных с подозрением на ИЗЛ-подобные симптомы являются: пневмонит, интерстициальная пневмония, лучевой пневмонит, аллергический интерстициальный пневмонит, интерстициальное заболевание легких, облитерирующий бронхиолит, фиброз легких, острый респираторный дистресс-синдром, инфильтрация легких и альвеолит.
Перечисленные ИЗЛ-подобные явления возникали в период от несколько дней до нескольких месяцев после начала терапии препаратом Тарцева®. Большинство случаев было связано с отягчающими или способствующими факторами, такими как сопутствующая или ранее проводимая химиотерапия, лучевая терапия, паренхиматозное заболевание легких в анамнезе, метастатическое поражение легких или инфекция. При остром развитии новых и/или прогрессировании необъяснимых легочных симптомов (одышка, кашель и лихорадка) прием препарата Тарцева® необходимо временно прекратить до выяснения причины. В случае подтверждения диагноза ИЗЛ необходимо отменить препарат Тарцева® и провести необходимое лечение.
Диарея, дегидратация, электролитные нарушения и почечная недостаточность
При возникновении тяжелой или умеренной диареи необходимо назначить лоперамид. В некоторых случаях может потребоваться снижение дозы препарата Тарцева®.
При тяжелой или устойчивой диарее, тошноте, анорексии или рвоте с обезвоживанием, терапия препаратом Тарцева® должна быть прервана и проведена регидратация. Сообщалось о редких случаях развития гипокалиемии и почечной недостаточности, в т.ч. с летальным исходом.
Некоторые случаи почечной недостаточности были вызваны тяжелой дегидратацией вследствие диареи, рвоты и/или анорексии, другие - сопутствующей химиотерапией. В случаях тяжелой или устойчивой диареи или состояниях, приводящих к дегидратации, особенно у пациентов в группе риска (сопутствующая терапия или заболевания, или при наличии других предрасполагающих факторов, в т.ч. пожилой возраст), препарат Тарцева® временно отменяют и проводят парентеральную регидратацию. У пациентов с высоким риском дегидратации следует контролировать электролиты сыворотки крови, включая калий, и функцию почек.
Гепатит, печеночная недостаточность
Во время приема препарата Тарцева® сообщалось о редких случаях печеночной недостаточности, включая случаи с летальным исходом. Рекомендуется периодически контролировать функцию печени пациентам с сопутствующими заболеваниями печени или получающим гепатотоксичные лекарственные средства. При развитии тяжелого поражения печени прием препарата Тарцева® прекращают.
Перфорация ЖКТ
Пациенты, получающие препарат Тарцева®, имеют повышенный риск развития перфорации ЖКТ, наблюдавшиеся нечасто, в некоторых случаях с летальным исходом. В группу повышенного риска входят пациенты, получающие сопутствующую терапию антиангиогенными препаратами, ГКС, НПВП и/или химиотерапию на основе таксанов, или пациенты, имеющие в анамнезе пептическую язву или дивертикулярную болезнь.
В случае развития перфорации ЖКТ терапию препаратом Тарцева® следует прекратить.
Буллезные или эксфолиативные нарушения
Сообщалось о случаях буллезных, сопровождающихся образованием волдырей и эксфолиативных нарушений, в т.ч. об очень редких случаях подозрения на развитие синдрома Стивенса-Джонсона/токсического эпидермального некролиза, в некоторых случаях с летальным исходом. В случае развития тяжелых буллезных, сопровождающихся образованием волдырей или эксфолиативных поражений кожи, лечение препаратом Тарцева® должно быть приостановлено или прекращено.
Офтальмологические нарушения
При применении препарата Тарцева® зарегистрированы очень редкие случаи перфорации или изъязвления роговицы. При лечении препаратом Тарцева® наблюдались и другие офтальмологические нарушения, включая неправильный рост ресниц, сухой кератоконъюнктивит или кератит, которые также являются факторами риска развития перфорации/изъязвления роговицы. Лечение препаратом Тарцева® должно быть приостановлено или отменено при появлении острых офтальмологических симптомов, таких как боль в глазу, или ухудшении хронических офтальмологических заболеваний.
Утилизация препарата
Утилизацию препарата Тарцева® следует проводить в соответствии с локальными требованиями.
Влияние на способность управлять транспортными средствами и другими механизмами, требующими повышенной концентрации внимания
Исследования по изучению влияния препарата на способность управлять автомобилем и работать с механизмами не проводились. Однако эрлотиниб не влияет на способность к концентрации внимания.
Условия хранения
Срок годности
Условия отпуска
Производитель
Характеристики
Цены в аптеках на Тарцева 150 мг, таблетки, покрытые пленочной оболочкой, 30 шт.

История стоимости Тарцева 150 мг, таблетки, покрытые пленочной оболочкой, 30 шт.
Цены Тарцева и наличие в аптеках в Москве
Отзывы о Тарцева
Дистанционная торговля лекарственными препаратами осуществляется исключительно аптечными организациями, имеющими действующую лицензию на фармацевтическую деятельность, а также разрешение на дистанционную торговлю лекарственными препаратами. Дистанционная торговля рецептурными лекарственными препаратами, наркотическими и психотропными, а также спиртосодержащими лекарственными препаратами запрещена действующим законодательством РФ и не осуществляется.
На информационном ресурсе применяются рекомендательные технологии .